اسیدهای آمینه اغلب با کمک پیوند پپتیدی به یکدیگر متصل شده و پروتئینها را می ساند. در این درس به بررسی ویژگیهای پپتیدها و پیوندهای پپتیدی پرداخته شده است
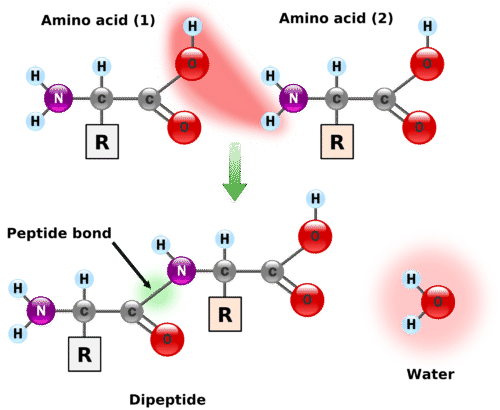
اتصال خطی اسیدهای آمینه در نتیجه پیوند پپتیدی منجر به تولید پپتید می شود. پیوند پپتیدی پیوندهای کووالانی هستند که بین جفت الکترونهای جفت نشده اتم نیتروژن گروه آمینی یک اسید آمینه با کربوکسیل اسید آمینه دیگر شکل می گیرد. تصویر زیر شکل شماتیک اتصال گروه آمین و کربوکسیل دو اسید آمینه و تشکیل پیوند پپتیدی همراه با آزاد شدن یک مولکول آب را نشان می دهد. پیوند پپتیدی نوعی واکنش دهیدراتاسیون است و آنچه پس از تشکیل پیوند در هر اسید آمینه باقی می ماند، باقی مانده( همان زنجیره جانبی) نام دارد.
وقتی دو اسید آمینه در نتیجه پیوند پپتیدی به هم متصل شوند یک پپتید شکل می گیرد. برای مثال اتصال یک گلیسین به یک سرین دی پپتید گلیسین-سرین تولید می کند. اضافه شدن اسید آمینه جدید به این دی پپتید از سر کربوکسیل آن ادامه می یابد و به این ترتیب همواره در سمت چپ رشته گروه آمین ( N-ترمینال) و در سر راست، گروه کربوکسیل (C-ترمینال) وجود خواهد داشت.
واکنش تشکیل پیوند پپتیدی یک واکنش برگشت پذیر است اما از آنجا که انرژی فعالسازی واکنش برگشت بسیار بالاست ( KJmol-1 80-130) فرایند شکستن پیوند پپتیدی با سرعت بسیار پایین رخ داده و نیازمند کاتالیزور یا آنزیمها است.
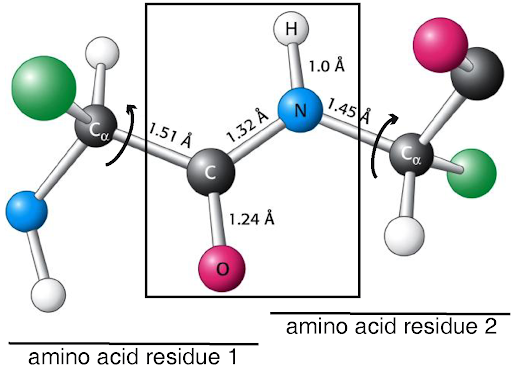
پلی پپتیدهای بزرگ معمولا ساختار سه بعدی مشخصی دارند. این ساختار مستقیما به توالی اسیدهای آمینه و ویژگیهای فیزیکو شیمیایی آنها و پیوند پپتیدی مربوط می شود. در اوایل دهه 50 میلادی لینوس پاولینگ و همکارانش یا کمک کریستالوگرافی اشعه ایکس پروتئین دریافتند که پیوند پپتیدی پیوندی با طول 33/1 آنگستروم ، سخت و خطی است ( تصویر15-2). طول این پیوند که اتصال دهنده نیتروژن (N) از یک اسید آمینه به کربن (C) اسید آمینه دیگر است از یک پیوند طبیعی کوالان بین نیتروژن و کربن (~ 45/1 آنگستروم) کوتاهتر و از یک پیوند دوگانه ( ~24/1 آنگستروم) بلندتر است. در حقیقت پیوند پپتیدی پیوندی است که به صورت جزئی خاصیت دوگانه دارد. به این معنی که پیوند دوم رزونانس هیبرید است. بدلیل سختی پیوند پپتیدی تقریبا یک سوم پیوندهای موجود در زنجیره اصلی رشته پلی پپتیدی قدرت چرخش ندارند و تنوع ساختاری یک رشته پلی پپتیدی را محدود می کنند.
وجود رزونانس در پیوند پپتیدی موجب می شود این پیوند در محدوده 190 تا 230 نانومتر نور فرابنفش را جذب کند. این خاصیت مطالعه پروتئینها و پپتیدها را به کمک انواع تکنیکهای طیف سنجی مانند ماوراء بنفش- مرئی و یا دو رنگنمایی دورانی ممکن می سازد.
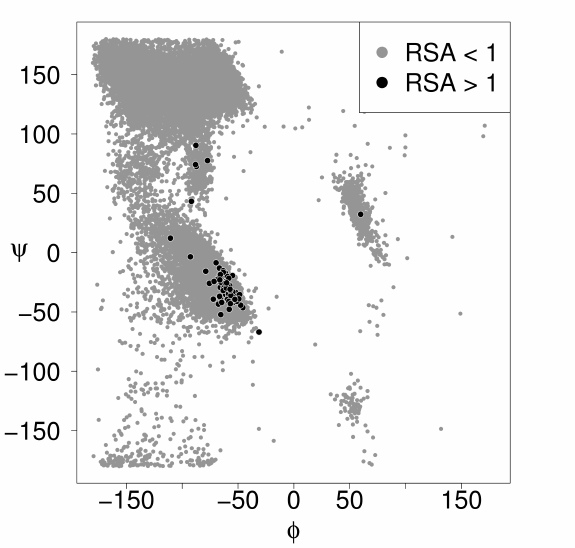
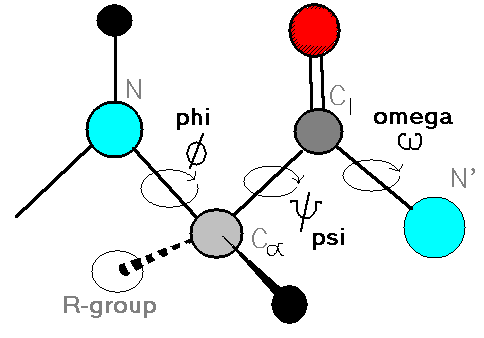
همانطور که گفته شد یک پیوند پپتیدی قدرت چرخشی قابل توجهی ندارد اما گروههای متصل به آن قادرند با در نظر گرفتن ممانعت فضایی حول این پیوند بچرخند. مهمترین زوایای چرخشی در پروتئینها و پپتیدها عبارتند از: زاویه چرخشی حول پیوند کربن آلفا-کربن پیوند Ψ (سای)، زاویه چرخشی حول پیوند کربن آلفا- نیتروژن زاویه Φ (فای)، زاویه بین کربن و نیتروژن متصل به پیوند پپتیدی زاویه امگا (ω) و زاویه چرخشی بین کربن آلفا و زنجیره جانبی زاویه کای ( χ) که در این میان دو زاویه سای و فای از اهمیت بیشتری برخوردارند.
از دیدگاه بیوفیزیکی زاویه فای محدودیتهای بیشتری نسبت به سای دارد چون همانطور که قبلا گفته شد فاصله واندروالسی مجاز بین دو اتم کربن 3 آنگستروم و فاصله مجاز برای دو اتم نیتروژن 2/7 انگستروم است. به این ترتیب فاصله بین دو کربن آلفا در زاویه فای کمتر از حد مجاز بوده و در نتیجه ممانعت فضایی بین دو اتم کربن وجود دارد درحالی که فاصله دو اتم نیتروژن در زاویه سای بیشتر از حد مجاز است پس اتمها به راحتی در کنار هم قرار می گیرند.
اما با توجه به ممانعت فضایی که سایر گروههای متصل بوجود می آورند، چرخش 360 درجه برای این دو زاویه ممکن نبوده و محدودیتهایی برای چرخش دارند. در فصل قبل دیدید که به دلیل وجود نیروهای واندروالسی، فاصله حداقلی باید بین اتمها وجود داشته باشد. به همین دلیل گروههای متصل به پیوند پپتیدی باید حریم یکدیگر را رعایت کرده و بیش از حد به یکدیگر نزدیک نشوند. محدوده آزاد چرخش برای هر دو این زوایا در یک پروتئین و یا برای یک اسید آمینه توسط دیاگرام راماچاندران نشان داده می شود. در این دیاگرام در محور عمودی زاویه سای ( محدوده 180+ تا 180- درجه) و در محور افقی زاویه فای ( 180+ تا 180- درجه) دیده می شود. محدوده های مجاز چرخش معمولا یه رنگ سفید، محدوده تا حدی مجاز خاکستری و محدوده ممنوع به رنگ سیاه دیده می شود. این دیاگرام نشان می دهد که علی رغم مستقل بودن زوایای سای و فای، بر یکدیگر تاثیر گذارند و ساختاری پایدار است که در محدوده مجاز هر دو زاویه قرار داشته باشد.