پروتئینها مهمترین ماکرومولکولهای زیستی هستند که تقریبا مسئولیت انجام اکثر واکنشهای زیستی را به عهده دارند. در این درس به بررسی ویژگیها و ساختار پروتئینها پرداخته شده است.
در میان تمام مولکولهایی که در ارگانیزمهای زنده وجود دارند، پروتئینها بیشترین تنوع را به شرح زیر دارند:
1. نقش کاتالیزوری: کاتالیزورهای پروتئینی یا آنزیمها هزاران واکنش بیوشیمیایی را همچون هضم، تولید انرژی، تنفس سلولی و یا بیوسنتز تسریع می کنند. این مولکولها ویژگیهای منحصربفرد و قابل توجهی دارند. برای مثال، آنزیمها سرعت واکنشهای آنزیمی را 106 تا 1012 برابر می کنند. از انواع آنزیمها می توان به آنزیمهای دخیل در فتوسنتز مانند ریبولوز بیس فسفات کربوکسیلاز و یا نیتروژناژ ( آنزیم تثبیت کننده نیتروژن) اشاره کرد.
2. نقش ساختاری: پروتئینهای ساختاری اغلب ویژگیهای اختصاصی دارند. برای مثال کلاژن ( پروتئین اساسی در بافتهای پیوندی) و فیبروئین ( پروتئینهای ابریشم مانند) مقاومت و پایداری مکانیکی بسیار زیادی دارند. الاستین یک پروتئین کشسان است و در رشته های انعطاف پذیر موجود در رگهای خونی و پوست دیده می شود.
3. نقش حرکتی: پروتئینها در تمام حرکتهای سلولی دخیل اند. اکتین، توبولین و سایر پروتئینهای اسکلت سلولی در همین دسته اند. پروتئینهای اسکلت سلولی در تقسیم سلول، اندوسیتوز، اگزوسیتوز و حرکتهای آمیبی گلبولهای سفید خون نقش دارند.
4. نقش دفاعی: دسته بزرگی از پروتئینها، پروتئینهای دفاعی اند. در مهره داران کراتین ( پروتئین موجود در سلولهای پوست) به محافظت از سلول در برابر آسیبهای شیمیایی و مکانیکی کمک می کند. فیبرینوژن و ترومبین خون مانع از از دست رفتن خون در نتیجه بریدگیها و جراحتها می شود. ایمونوگلوبولین ها ( آنتی بادیها) توسط لنفوسیتها در پاسخ به عوامل مهاجم مانند باکتریها ترشح می شوند. اتصال آنتی بادیها به عامل عفونت زا اولین گام در حذف این عوامل از بدن موجود زنده است.
5. نقش تنظیمی: اتصال یک مولکول هورمون و یا فاکتور رشد به جایگاه اتصال و گیرنده خود عملکردهای سلول را تنظیم می کند. برای مثال انسولین و گلوکاگن هورمونهای پپتیدی هستند که سطح قند خون را تنظیم می کنند. هورمون رشد، رشد سلولها و تقسیم شدن آنها را تنظیم می کند. فاکتورهای رشد پلی پپتیدهایی هستند که تقسیم و تمایز یافتگی سلول را کنترل می کنند.
6. انتقال دهنده: بسیاری از پروتئینها به عنوان ناقل مولکولها و یا یونها از غشاء سلول و یا بین سلولها عمل می کنند. آنزیم سدیم-پتاسیم ATPase از جمله پروتئینهایی است که یونهای سدیم و پتاسیم را از خلال غشاء جابجا می کند. سایر انتقال دهنده ها مانند هموگلوبین (انتقال دهنده اکسیژن)، لیپوپروتئینهای LDL و HDL ( انتقال دهنده لیپیدهای نامحلول خون) ، ترانسفرین و سرولوپلاسمین (پروتئینهای انتقال دهنده مس در خون) هستند.
7. نقش ذخیره ای: بعضی از پروتئینها ذخیره کننده مواد مغذی اصلی و اساسی سلول یا بافت هستند. برای نمونه پروتئین اوآلبومین در تخم پرندگان و کازئین شیر در پستانداران منبع غنی از نیتروژن مورد نیاز برای رشد و تکامل است. پروتئینهای گیاهی مانند زئین نقش مشابهی در جوانه زنی دانه ها دارند. 8. پاسخ به استرسها: توان موجودات زنده در برابر انواع استرسها و عوامل کشنده در پروتئینها است. سیتوکروم P450 در سلولهای گیاهی و یا جانوری همواره آلاینده های آلی سمی را به مشتقاتی غیر سمی یا با سمیت کمتر تبدیل می کند. متالوتیونین به فلزاتی مانند کادمیوم، جیوه و نقره در سلولهای پستانداران متصل شده و سمیت آنها را کاهش می دهد. دمای بالای محیط و یا سایر استرسهای محیطی که تاخوردگی پروتئین را مختل می کنند توسط پروتئینهای شوک حرارتی بی اثر می شوند. در صورتی که پروتئینهای سلولی در نتیجه استرسها آسیب ببینند، این پروتئینها آنها را از سلول حذف می کنند.
علاوه بر طبقه بندی پروتئینها بر اساس عملکرد، پروتئینها را بر اساس شکل و ساختار نیز طبقه بندی می کنند. دو دسته اصلی پروتئینها بر این اساس عبارتند از پروتئینهای رشته ای و پروتئینهای کروی. این نوع از طبقه بندی در مطالعات بیوفیزیکی بیشتر مورد استفاده قرار میگیرد. پروتئینهای رشته ای درشت مولکولهای بلند و استوانه ای شکل و نامحلولی هستند و در بافتهای پیوندی و بافتهای با استقامت بالا مانند پوست، مو و ناخن دیده می شوند. پروتئینهای کروی یا گلوبولار مولکولهایی فشرده و کروی و معمولا محلول در آب بوده و بیشترین نقش را در عملکردهای سلولی دارند. برای مثال بیشتر آنزیمها، پروتئینهای سیستم دفاعی یا ایمونوگلوبولینها، پروتئینهای انتقالی مانند هموگلوبین و یا آلبومین کروی اند.
بر اساس ترکیبات تشکیل دهنده پروتئینها به دو دسته ساده و مرکب یا کونژوکه تقسیم می شوند. پروتئینهای ساده مانند آلبومین سرم و کراتین در ساختار خود تنها اسید آمینه دارند درحالی که در پروتئینهای مرکب علاوه بر اسید آمینه گروههای غیر پروتئینی نیز دیده می شود. گروه غیر پروتئینی این پروتئینها معمولا گروه پروستتیک نامیده می شود. پروتئین مرکبی که گروه پروستتیک آن حذف شده باشد، آپوپروتئین و مجموع بخش پروتئینی و گروه پروستتیک هولوپروتئین نام دارد.گروه پروستتیک معمولا برای عملکرد پروتئین حیاتی است و به همین دلیل پروتئینهای مرکب را بر اساس ویژگیهای گروه پروستتیک آنها دسته بندی میکنند. برای مثال گلیکوپروتئینها، لیپوپروتئینها و متالوپروتئینها به ترتیب دارای گروه کربوهیدرات، لیپید و فلزی هستند.
1- ساختار پروتئینها
در محیط سلول، پروتئینها در شرایط مختلفی به سر می برند که این شرایط قطعا بر ساختار و ویژگیهای ساختاری آنها موثر است. برای مثال مقدار آب در نواحی مختلف سلول متفاوت است و از این رو تعداد پیوندهای هیدروژنی ممکن نیز در نواحی مختلف سلول فرق می کند. بر اساس شرایط محیطی حاکم بر پروتئینها، پروتئینها از نظر ساختاری به سه دسته تقسیم می شوند:
1-1 ساختمان اول
هر پروتئین دارای توالی اسید آمینه ای منحصر به خود است. میانکنش میان اسیدهای آمینه این توالی ساختار سه بعدی و در نتیجه عملکرد پروتئین را تعیین می کند. پلی پپتیدهایی که توالی اسید آمینه ای مشابه دارند و از یک ژن اجدادی مشترک منشاء می گیرند را اصطلاحا همولوگ می نامند. طی تکامل معمولا توالی ژنومی دستخوش تغییراتی شده و به صورت تصادفی تغییر می کند. این تغییرات که جهش نامیده می شود ساختمان اول پروتئین را تغییر می دهند.
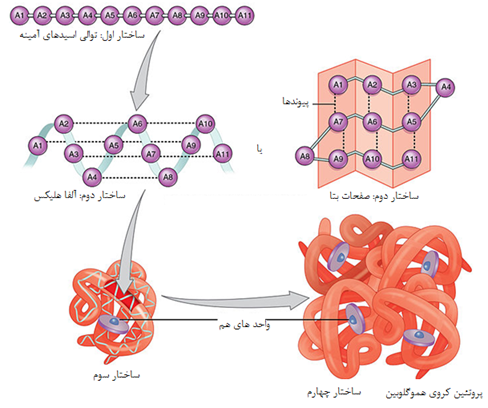
1-2ساختمان دوم
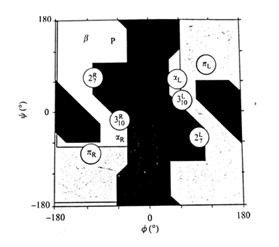
در تعریف کلی، ساختمان دوم پروتئین را ساختمان های منظم تکرار شونده تعریف می کنند اما این تعریف برای تمامی ساختارهای دوم صدق نمی کند. معمول ترین ساختمانهای دوم مارپیچهای ( هلیکسها) و صفحات بتا ( β شیت) و پیچه های تصادفی هستند. همگی این ساختارها توسط تشکیل پیوند های غیر کووالان ( به جز پیوند دی سولفید) بویژه پیوند هیدروژنی بین C=O و N-H زنجیره اصلی رشته پپتیدی ایجاد می شوند. زوایای تشکیل این پیوندها از دیاگرام راماچاندران تبعیت می کند.
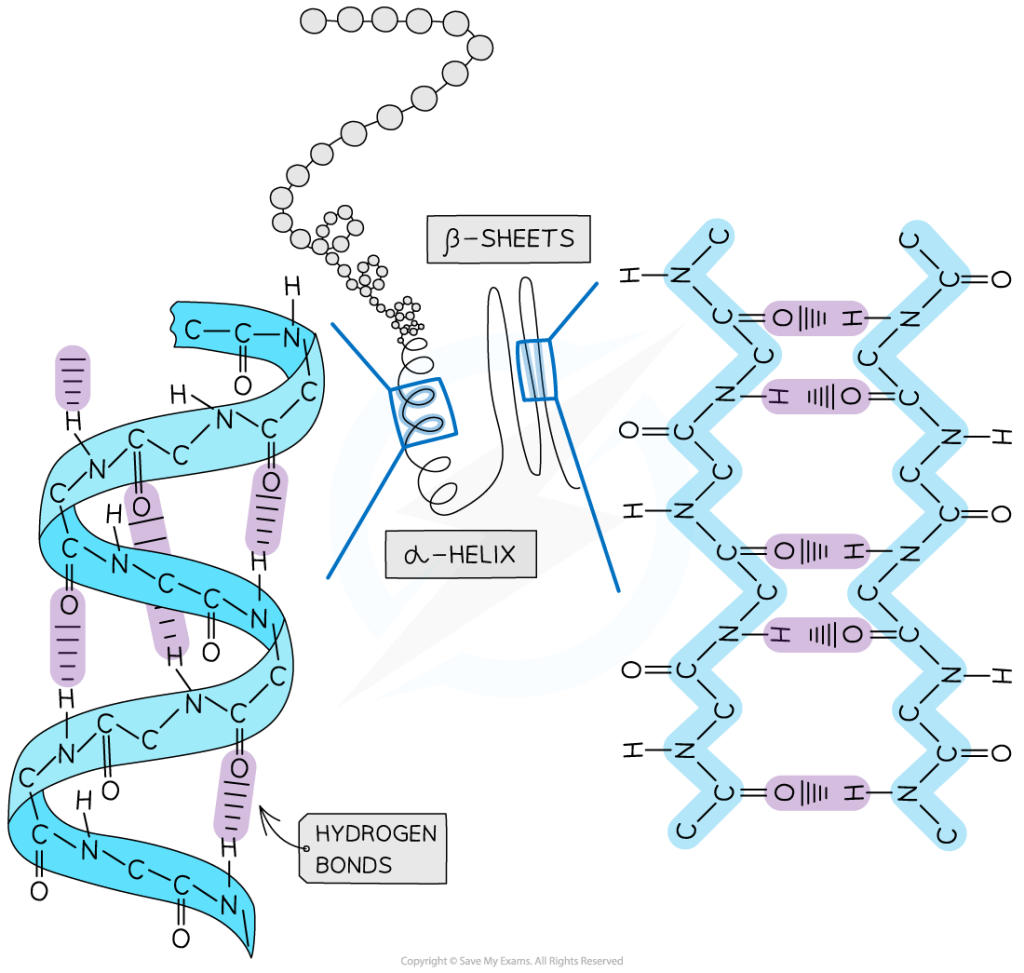
اساسا چند نوع مارپیچ در طبیعت وجود دارد که عبارتند از: 27، 310، 413 ( آلفا) و 516 (π). مارپیچ 27 به این معنی است که در تشکیل پیوند هیدروژنی دو اسید آمینه شرکت کرده و در هر دور مارپیچ 7 اتم دیده می شود. بر همین اساس تمامی مارپیچها نامگذاری می شوند.
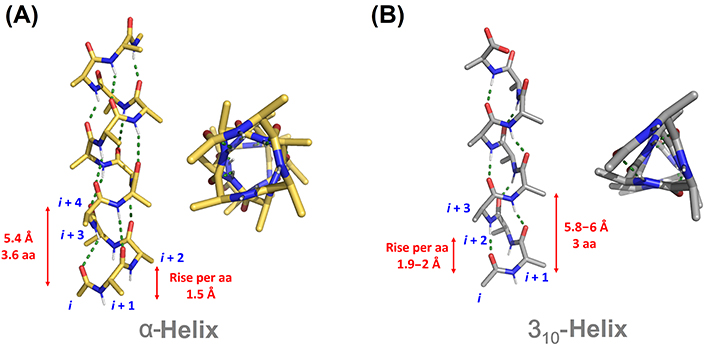
مارپیچ 27 ندرتا در پروتئینها وجود دارد چراکه زاویه پیوند هیدروژنی بین C=O و N-H بسیار بسته بوده و در نتیجه پیوندهای هیدروژنی محکمی ندارند. مارپیچ π نیز در پروتئینها دیده نمی شود. چون در در نواحی کاملا مجاز دیاگرام راماچاندران قرار ندارند ( تصویر 25-2). در مقابل مارپیچ 310 ( عمدتا در شکل راستگرد دیده می شود و شکل چپگرد آن تنها برای گلیسین مورد استفاده قرار می گیرد) در توالیهای کوتاه در پروتئینها وجود دارد. مارپیچهای آلفا راستگرد فراوانترین نوع مارپیچ در ساختمان پروتئینها هستند. چون زوایای سای و فای درمارپیچ آلفا معمولا در نواحی مجاز دیاگرام راماچاندران قرار میگیرند. زاوایای سای و فای مارپیچهای آلفا به ترتیب °7 ± 41- و °7 ± 64- است.
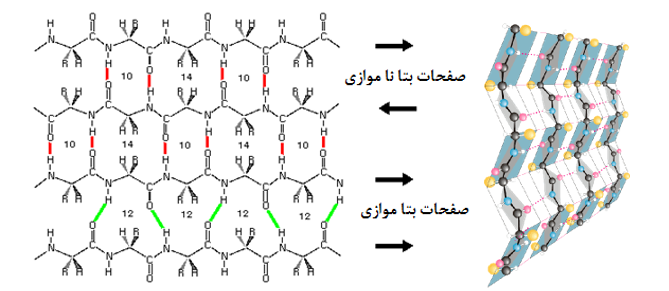
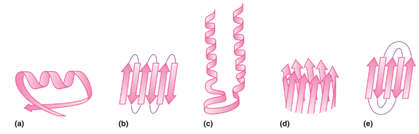
صفحات بتا: بر خلاف ساختارهای مارپیچ که پیوندها به صورت درون زنجیر و پشت سر هم رخ می دهد در صفحات بتا پیوند بین اسیدهای آمینه های دور از هم اتفاق می افتد. این صفحات زمانی تشکیل می شوند که دو یا چند قطعه پلی پپتیدی در کنار هم قرار بگیرند (تصویر 27-2). هر قطعه یک رشته بتا نامیده می شود. معمولا هر صفحه بتا از 15-2 رشته تشکیل می شوند. معمولا صفحات بتا با کمتر از 5 زنجیره بدلیل پایداری کم ندرتا در ساختار پروتئینها دیده می شود. در این ساختار زنجیره پیچش پیدا نکرده بلکه تنها کمی چین خورده است. این ساختار نیز مانند مارپیچ ها توسط پیوندهای هیدروژنی پایدار می شود با این تفاوت که در این ساختار پیوند بین رشته های مجاور اتفاق می افتد. تاخوردگی صفحات بتا به دلیل جهت گیری تتراهدرال اتم کربن، عمود بر جهت زنجیره اصلی است. هر زنجیره پلی پپتیدی در صفحات بتا، رشته بتا نامیده شده و شامل 10-5 اسید آمینه است. آرایش رشته های بتا به سه صورت موازی، ناموازی و ترکیبی منجر به تولید صفحات بتا موازی، یا ناموازی و ترکیبی می شود. در ساختارهای بتا موازی پیوندهای هیدروژنی بین دو قطعه پلی پپتیدی همسو (هر دو از سر آمین و یا هر دو از سر کربوکسیل ) شکل می گیرد. اما در صفحات بتا ناموازی رشته های بتا نا همسو ( یکی از سر آمین و دیگری از سر کربوکسیل) هستند
اسیدهای آمینه حجیم مانند تریپتوفان، تیروزین و فنیل آلانین و یا اسیدهای آمینه منشعب مانند ترئونین، والین و ایزولوسین با محدودیت کمتری نسبت به ساختارهای مارپیچ آلفا در صفحات بتا دیده می شوند. در این نوع از ساختارها نیز پرولین بیشتر در نواحی انتهایی ساختار قرار می گیرد. به نظر می رسد وجود پرولین در نواحی انتهایی مانعی برای ایجاد اتصال بین ساختارهای بتا مجاور و تجمعات پروتئینی (مانند آنچه که در تشکیل آمیلوئیدها رخ می دهد) باشد.
همانطور که گفته شد در پروتئینهای کروی، صفحات بتا کاملا صفحه ای نبوده و به اندازه 30-0 درجه در هر اسید آمینه پیچش دارند. در بین انواع صفحات بتا، انواع ناموازی و بویژه صفحات بتا ناموازی ساخته شده از دو رشته، بیشتر از سایرین دچار پیچش می شوند. این مساله به دو دلیل روی می دهد: اول اینکه به دلائل آماری چرخش زوایای سای و فای در صفحات بتا نا منظم به صورت راستگرد مطلوبتر است بعلاوه اعوجاج نیتروژن تتراهدرال منجر به چرخش راستگرد در صفحات بتا می شود.
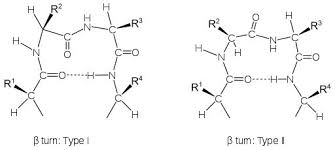
در کنار ساختمانهای دوم منظم، ساختارهای نامنظمی نیز در پروتئینها دیده می شوند که معمولا از رشته بسیار کوتاهی اسید آمینه تشکیل می شوند. مهمترین این نوع ساختارها ترن[1] نام دارد. ترنها و یا بتا-ترنها برای تغییر جهت ناگهانی قطعات ساختار دوم مورد استفاده قرار میگیرند بویژه که معمولا متوسط قطر یک دومین در پروتئینهای کروی حدودا 5/2 نانومتر است و وجود ترنها برای تغییر جهت سریع در فضای اندک کاملا مفید و موثر است (تصویر 28-2). یک بتا-ترن ساختاری است متشکل از 4 اسید آمینه که در آن پیوند هیدروژنی بین گروه کربونیل اسید آمینه iام و گروه آمین اسید آمینه 3+ iام تشکیل می شود. دو شرط اصلی برای تشکیل ترن عبارتند از 1) پیوند هیدروژنی باید حتما با کربن آلفا باشد. 2) فاصله بین اسید آمینه iام و 4+ i ام باید کمتر از 7 آنگستروم باشد. بر اساس زوایای سای و فای اسیدهای آمینه 1+i و 2+i در ساختمان ترن، ترنها به نه گروه تقسیم می شوند که فراوانترین آنها دو گروه I و II هستند.
در ساختمان بسیاری از پروتئینهای کروی ترکیبی از هر دو ساختار هلیکس و صفحات بتا دیده می شود. یک یا چند مارپیچ در کنار یک یا چند صفحه بتا قرار گرفته و دسته های ساختاری را به نام موتیف می سازند. تعریف و دسته بندی کامل و ثابتی برای انواع موتیفهای پروتئینی وجود ندارد.
1-3 ساختمان سوم
ساختمان سوم یک پروتئین ساختمان سه بعدی و فضایی و فعال آن است. اگرچه در یک پروتئین کروی و گلوبولار تعداد مشخصی عناصر ساختار دوم وجود دارد اما عوامل دیگری نیز در شکل گیری سه بعدی پروتئین دخالت می کند. روند شکل گیری ساختمان سوم اصطلاحا تاخوردگی نامیده می شود روندی که در آن یک ماکرومولکول بی نظم و تازه ساخته شده توسط زنجیره ای از وقایع شیمیایی و فیزیکی به ماکرومولکولی بسیار منظم و فعال تبدیل می شود. ساختار سوم دارای مشخصه های زیر است:
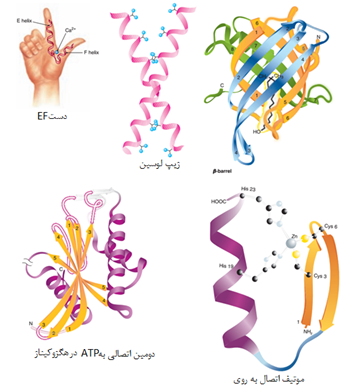
1-4 ساختمان چهارم پروتئین
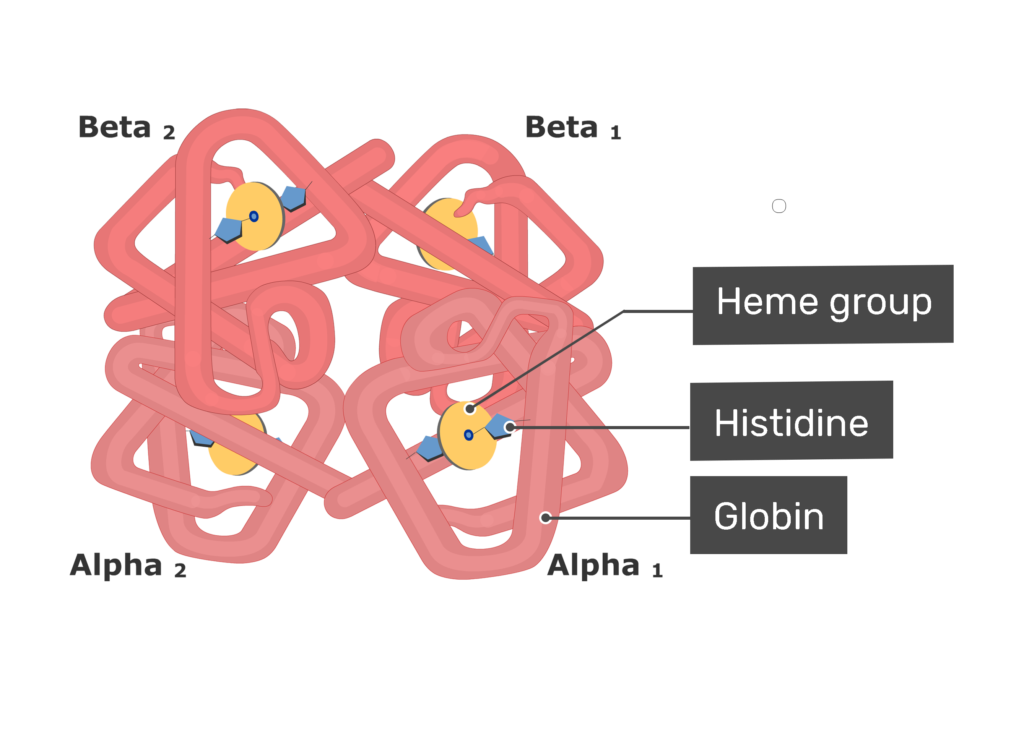
برخی از پروتئینها مانند میوگلوبین تنها از یک زنجیره پلی پپتیدی ساخته می شوند درحالی که در بسیاری از پروتئینهای سنگین چندین زنجیره پلی پپتیدی وجود دارد. هر کدام از این زنجیره ها یک زیر واحد نامیده می شود. زیرواحدها ممکن است مشابه یا کاملا متفاوت باشند. پروتئینهای چند زیر واحدی که در آنها دو یا چند زیرواحد مشابه یکدیگر هستند ، الیگومر نامیده می شوند. الیگومرها از پروتومرها ساخته می شوند که شامل یک یا چند زیرواحد هستند. بسیاری از پروتئینهای الیگومریک دو یا چهار زیرواحد پروتومر دارند و دیمر یا تترامر نامیده می شوند. زیر واحدهای پروتئینهای چند زیر واحدی معمولا با کمک پیوندهای غیرکووالان مانند هیدروفوب ، الکترواستاتیک، هیدروژنی و در برخی مواقع پیوندهای کووالان به هم متصل می شوند.
یکی از معروفترین پروتئینهای چند زیرواحدی، هموگلوبین است. هر مولکول هموگلوبین از چهار زنجیره ساخته شده که دو به دو آلفا و بتا نامیده می شوند. ساختار هر کدام از این رشته ها شبیه به میوگلوبین است. برخلاف هموگلوبین، در سایر پروتئینهای چند زنجیری یوکاریوتی ممکن است هر کدام از زنجیره ها با دیگری کاملا متفاوت باشد.