بطور کلی پروتئینها ابزارهای مولکولی هستند که نقشهای متنوعی اعم از ساختاری ( رشته های اکتین و میوزین) و یا عملکردی ( آنزیمی، انتقال دهنده و یا دفاعی ) در سلول و اندامهای زنده دارند. هر مولکول پروتئینی از یک یا تعداد بیشتری رشته پلی پپتیدی و رشته های پلی پپتیدی از تعداد زیادی واحد ساختاری به نام اسید آمینه تشکیل شده است
هیدرولیز پروتئینها منجر به تولید دسته ای از مولکولهای شیمیایی به نام اسید آمینه می شود. همانطور که از نام این مولکول پیدا است در ساختار آن هم گروه آمینی (گروه قلیایی) و هم گروه کربوکسیل به عنوان گروه اسیدی وجود دارد (تصویر 2-2). به همین دلیل هر دو خاصیت اسیدی و قلیایی را می تواند از خود نشان دهد. هر اسید آمینه از یک کربن آلفا که به چهار گروه کربوکسیل، آمین، هیدروژن و زنجیره جانبی متصل است، تشکیل می شود.
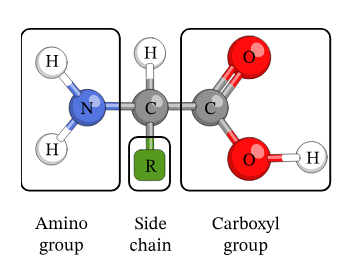
از دیدگاه شیمی آلی در یک مولکول، کربنی که دقیقا پس از گروه کربوکسیل قرار می گیردکربن آلفا نامیده می شود. کربنهای بعدی با حروف بتا (β) ، گاما (γ) و دلتا (δ) نشان میدهند. در اسیدهای آمینه نیز از آنجا که کربن مرکزی مستقیما به گروه کربوکسیل متصل است، کربن الفا نامیده می شود. در اسیدهای آمینه گروه کلیدی گروه آمین است. بنابراین اگر گروه آمین به کربن آلفا متصل باشد آن اسید آمینه را آلفا می نامند. مطابق قرار داد اگر در ساختمان فضایی یک اسید آمینه عامل NH2 که به کربن آلفا متصل است در طرف چپ باشد، این اسید آمینه از نوع L است و هرگاه عامل NH2 در طرف راست کربن آلفا قرار گیرد، اسید آمینه از نوع D است. برخلاف قندهای طبیعی که از نوع D هستند، اسیدهای آمینه طبیعی همگی از نوع L میباشند.
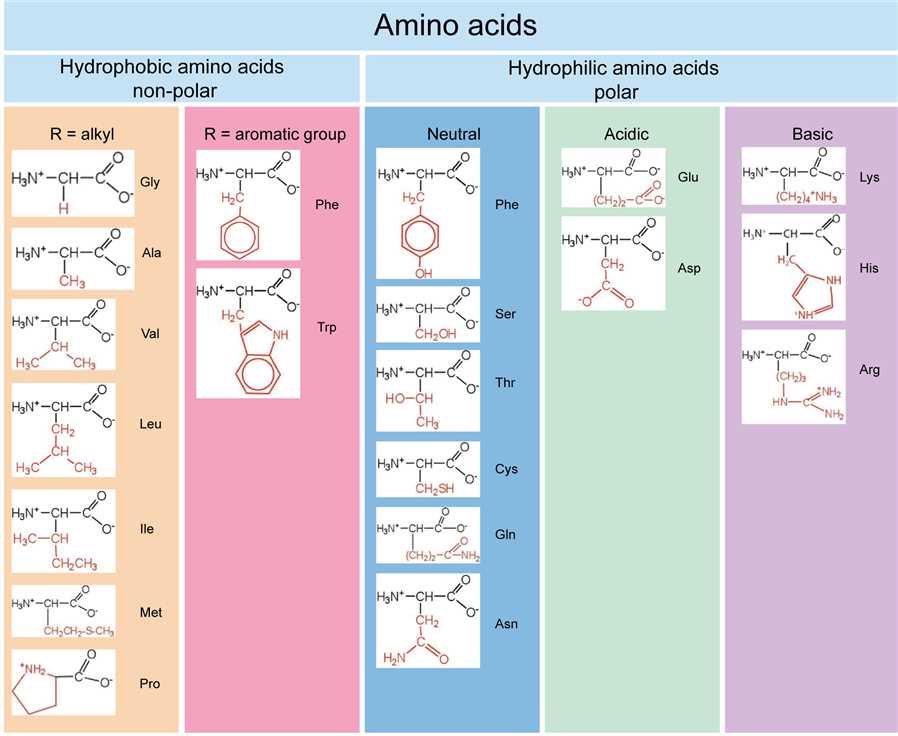
گروه زنجیره جانبی هر اسید آمینه، بخشی از ساختار آن است که آن را از سایرین متمایز می کند. این گروه می تواند تنها یک هیدروژن و یا یک ساختار با حلقه بنزنی باشد. ویژگیهای شیمیایی زنجیره جانبی تعیین کننده ویژگیهای فیزیکوشیمیایی اسید آمینه خواهد بود. با توجه به تنوع ساختاری اسیدهای آمینه هر کدام نام اختصاصی خود را دارند. اسیدهای آمینه هم به صورت سه حرفی ( مانند Gly برای گلیسین) و هم تک حرفی ( مانندG برای گلیسین) نامگذاری می شوند. در تصویر زیر تمامی 20 نوع اسید آمینه طبیعی یا استاندارد به همراه ساختار و ویژگیهای آنها آورده شده است.
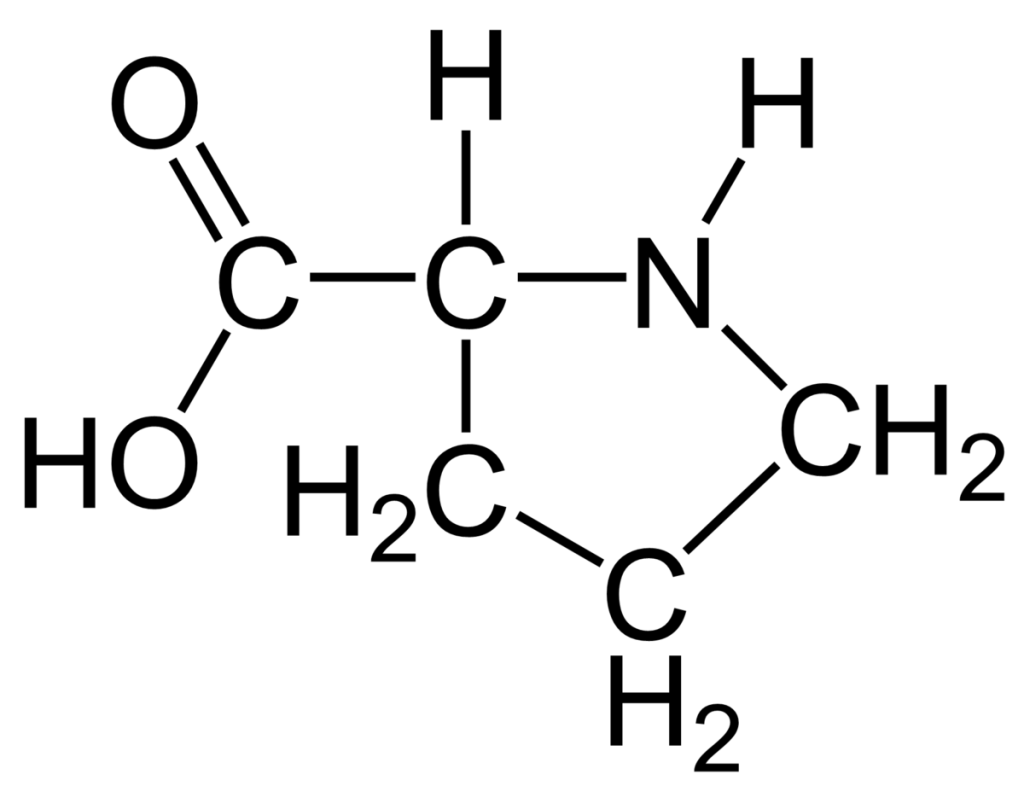
نوزده اسید آمینه دارای ساختار عمومی مشابه اند اما ساختار مولکولی برای اسید آمینه پرولین استثناء است. در این اسید آمینه نیتروژن گروه آمینو به زنجیره جانبی متصل شده است و حلقه ایمین تشکیل می دهد. از این رو اسید آمینه پرولین یک ایمینو اسید نیز نامیده می شود. ساختار خاص پرولین انعطاف پذیری آن را به شدت کاهش می دهد چراکه چرخش و حرکت حول اتم کربن آلفا در این حالت غیر ممکن است. این مساله بر عملکرد پروتئینهایی که سرشار از پرولین اند (مانند ابریشم) تاثیر گذار است.
اسیدهای آمینه آروماتیک مانند تریپتوفان، تیروزین و فنیل آلانین بسیار حجیم و تا حد زیادی هیدروفوب هستند. تمامی این اسیدهای آمینه نور ماوراءبنفش را در طول موج 280 نانومتر جذب می کنند و همچنین عامل فلورسانس ذاتی پروتئینها هستند. تیروزین پیش ساز هورمون آدرنالین، نورآدرنالین، تیروکسین و دوپامین بوده و در انتقال سیگنال بین لیگاند و گیرنده موثر است. تریپتوفان بدلیل داشتن گروه ایندولی از بزرگترین اسیدهای آمینه بوده و در پیوندهای هیدروژنی به عنوان دهنده هیدروژن شرکت می کند. تریپتوفان پیش ساز دو ترکیب سروتونین و ملاتونین است که هر دو این ترکیبات در تنظیم ساعت بیولوژیک بدن نقش دارند.
ایزومرهای فضایی اسیدهای آمینه
از آنجاییکه کربن آلفای اسیدهای آمینه در 19 اسیدآمینه به چهار گروه متفاوت متصل است به عنوان یک کربن نا متقارن یا کایرال به حساب می آید. گلیسین تنها اسید آمینه ای است که کربن آلفای آن متقارن بوده وکایرال نمی باشد چرا که کربن آلفای آن به دو اتم هیدروژن متصل است. مولکولهایی با کربن آلفای کایرال دارای ایزومریزاسیون فضایی اند یعنی ساختمانهای ایزومری که تنها از نظر جهت قرارگیری گروهها با یکدیگر متفاوتند.
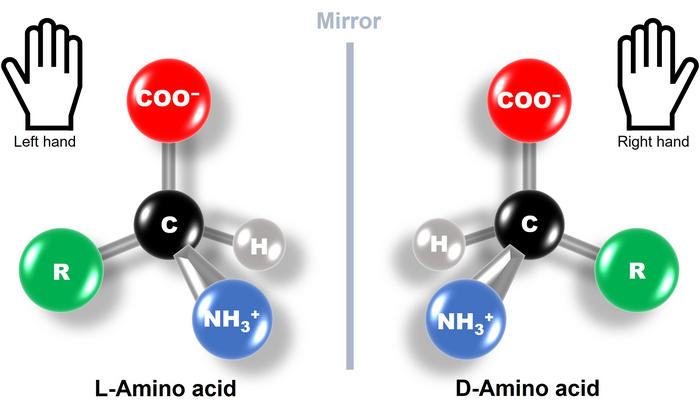
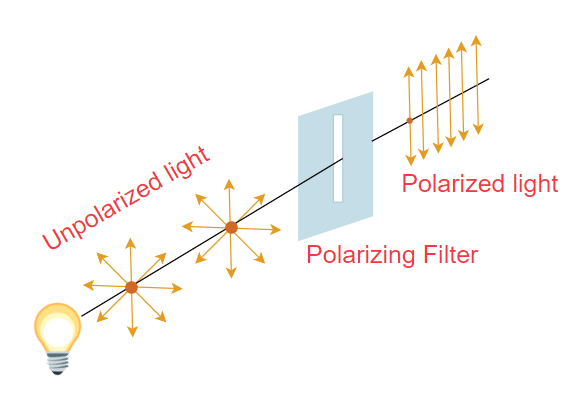
همانطور که در تصویر بالا دیده می شود، تمام گروههای متصل به کربن آلفا به جز گروه آمین و اتم هیدروژن دارای الگوی اتصال مشابه اند. این دو گروه تصویر آیینه ای یکدیگر اند و در نتیجه دو ایزومر قابل انطباق بر هم نیستند. چنین مولکولهایی انانتیومر نامیده می شوند. اناتیومرها ویژگیهای فیزیکی و شیمیایی مشابهی دارند و تنها تفاوت آنها در واکنش نسبت به نور قطبیده صفحه ای است. اناتیومرها نور قطبیده را در جهت های متفاوتی میچرخانند.
ایزومرهای نوری را بر مبنای ساختمان گلیسرآلدئید نامگذاری می کنند. ایزومری از گلیسرالدئید که گروه عاملی آن ( OH) سمت راست است D نامیده شده و اما گلیسرالدئیدی که گروه هیدروکسیل آن سمت چپ قرار دارد L نامیده شده می شود. بر همین مبنا، اگر گروه آمین اسید آمینه سمت راست باشد آن اسید آمینه D و اگر سمت چپ باشد L نامیده می شود. مانند L- الانین و D- الانین. این نامگذاری دقیقا نشان دهنده تقارن و آرایش فضایی مولکول است.
اسیدهای آمینه غیر استاندارد
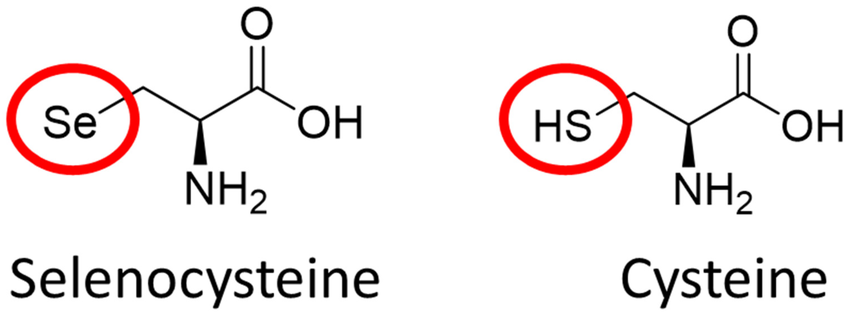
علاوه بر اسیدهای آمینه استاندارد بیش از 700 اسید آمینه غیر استاندارد وجود دارند که به صورت آزاد و یا در اتصال به پروتئینها درون و یا بیرون سلول دیده می شوند. اسیدهای آمینه غیر استاندارد اسیدهای آمینه ای هستند که زنجیره جانبی آنها پس از قرار گرفتن در ساختار پروتئین یا پلی پپتید دستخوش اصلاح و تغییر شده است. این نوع از اسیدهای آمینه ( به جز سلنوسیستئین) معمولا در پروتئینهایی با اصلاحات پس از ترجمه دیده می شود.
اسیدهای آمینه غیر استاندارد به دو دسته تقسیم می شوند: گروه اول اسیدهای آمینه ای که از نظر ساختاری با اسیدهای آمینه استاندارد متفاوتند و دسته دوم شکل D- اسیدهای آمینه که از نظر ساختاری کاملا با اسیدهای آمینه استاندارد مشابهند اما از نظر آرایش فضایی تفاوت دارند. به نظر می رسد که اسیدهای آمینه غیر استاندارد در جریان اصلاحات پس از ترجمه ایجاد می شوند و بیشتر آنها در نتیجه اتصال یک گروه عاملی شیمیایی تولید می شوند مانند هیدروکسیل پرولین و هیدروکسیل لیزین، فسفریل سرین و …. در این میان سلنوسیستئین استثناء است و این اسید آمینه مستقیما و از طریق tRNA اختصاصی خود وارد زنجیره پروتئینی می شوند. به همین دلیل این اسید آمینه را گاهی اسید آمینه21ام هم می دانند. سلنوسیستئین در نتیجه یکسری واکنشهای آنزیمی از اسید آمینه سرین تولید می شود .