پیوند ها اتصالات درون مولکولی هستند که اجزا یک ساختار پیچیده را در کنار یکدیگر قرار می دهند. در این درس به بررسی مهمترین پیونهای شیمیایی موجود در ساختارهای زیستی پرداخته شده است
1 پیوندهای کووالان
پیوند اشتراکی یا پیوند کووالانسی یک نوع پیوند شیمیایی هستند که در آن اتمها با به اشتراک گذاشتن الکترونها، مدار خودشان را پر می کنند تا به هشت تایی پایدار گاز نجیب بعد از خودشان برسند. پیوند کووالانسی در اثر نیروی جاذبه الکتریکی به وجود میآید. مثلاً هنگامی که دو اتم هیدروژن به هم نزدیک میشوند، جاذبه الکتریکی بین آنها ایجاد میشود و دو اتم با به اشتراک گذاشتن یک جفت الکترون کنار هم میمانند. پیوند کووالانسی اغلب بین دو اتم نا فلز است. مثلاً یک اتم کربن با چهار اتم هیدروژن چهار پیوند کووالانسی در یک مولکول به وجود میآورند که به متان معروف است.
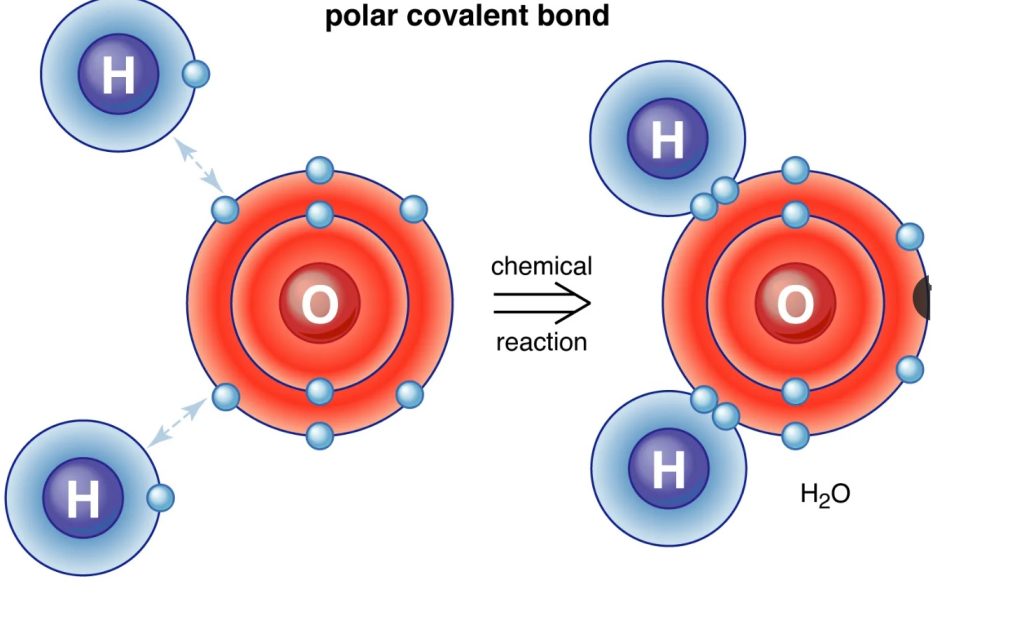
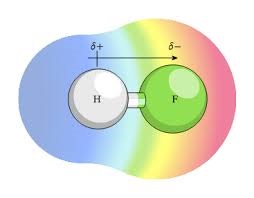
مطابق با نظریه لوویس، پیوند کووالانسی نتیجه اشتراک یک جفت الکترون (دو الکترون) بین دو اتم است. بر این اساس، الکترونهای مشترک توسط هسته هر دو اتم جذب شده و در نتیجه اتمها به هم پیوند (اتصال) می یابند.اگر الکترونهای پیوند کووالانسی به شکل متقارن بین دو هسته گردش نمایند، یک پیوند کووالانسی غیرقطبی شکل میگیرد؛ اما اگر الکترونها بیشتر وقت خود را نزدیک به یکی از هستهها باشند (بهطور میانگین به یک هسته نزدیکتر و از یک هسته دورتر باشند)، پیوند کووالانسی قطبی است؛ بدین معنی که یک سمت تجمع بار منفی و سمت دیگر کمی از بار منفی خالی شدهاست. بر اساس شکلگیری پیوندهای کووالانسی قطبی و غیرقطبی، پائولینگ مفهوم الکترونگاتیویته را شکل داد. الکترونگاتیویته ( با نماد χ نشان داده می شود) مفهومی است که تمایل اتم را برای جذب یک جفت الکترون مشترک یا تراکم ابر الکترونی به سمت خود توصیف می کند. الکترونگاتیویته یک اتم تحت تاثیر دو عامل تعداد الکترونها و فاصله الکترونهای لایه ظرفیت از هسته قرار می گیرند. در ابتدایی ترین سطح ، الکترونگاتیویته توسط عواملی مانند بار هسته تعیین می شود بطوریکه هرچه تعداد پروتونهای موجود در هسته اتم بیشتر باشد، کشش بیشتری روی الکترون ها اعمال خواهد کرد. اما هر چه تعداد الکترونها اتم بیشتر باشد تعداد لایه های الکترونی بیشتر بوده و در نتیجه لایه والانس دورتر از هسته قرار می گیرد. بعلاوه وجود سایر الکترونها همانند سدی مانع از رسیدن جاذبه هسته به لایه والانس می شود. در نقطه مقابل الکترونگاتیویته، الکتروپازیتیویته قرار میگرد که عبارت است از توانایی و تمایل یک اتم برای اهدا ابر الکترونی اطراف خود. مفهوم الکترونگاتیویته که در ابتدا توسط برزلیوس مطرح شده بود توسط پاولینگ در سال 1932 فرمول بندی شد. بر اساس نظر پاولینگ الکترونگاتیویته خاصیت یک اتم منفرد نبوده و زمانی معنا پیدا می کند که اتم درگیر پیوند می شود. همچنین مقدار الکترونگاتیویته و انرژی پیوند رابطه مستقیمی با یکدیگر دارند.
2 پیوندهای غیر کووالان
از آنجاییکه در پیوندهای غیر کوالان، اشتراک گذاری الکترونها وجود ندارد، این نوع از پیوند با پیوند های کووالان متفاوت است. در پیوند غیر کووالان، عمدتا تعاملات ضعیفتر الکترومغناطیسی بین مولکولها و یا درون مولکولها دیده می شود. انرژی شیمیایی آزاد شده در شکل گیری فعل و انفعالات غیر کووالانسی به طور معمول بین 5-1 کیلو کالری بر مول است.
اجزاء زنجیره اصلی پلی پپتیدها نیز توسط پیوندهای کووالان ( پیوند پپتیدی) به یکدیگر متصل می شوند. اما تمامی سطوح بالاتر ساختاری در پروتئین ها و پلی پپتیدها از میانکنشهای غیر کووالان بین زنجیره های جانبی اسیدهای آمینه شکل میگیرد. این میانکنشهای غیر کووالان عبارتند از : میانکنشهای الکتروستاتیک، میانکنشهای واندروالسی، میانکنشهای هیدروژنی و میانکنشهای هیدروفوب. تمامی این پیوندها بسیار ضعیف بوده و به سادگی تحت تاثیر محیط قرار می گیرند. با اینحال در ساختمان پروتئین به فراوانی وجود دارند وبه همین دلیل به عنوان پایدار کننده های ساختمان دوم و سوم پروتئینها در نظر گرفته می شوند. در این بخش به بررسی این پیوندها پرداخته خواهد شد.
2-1 میانکنشهای الکترواستاتیک
میانکنشهای الکترواستاتیک اساس تمامی میانکنشهای پیوندی و غیر پیوندی است که بین اتمها و مولکولهای باردار رخ می دهد. قدرت این پیوند به ثابت دی الکتریک محیط بستگی رابطه معکوسی دارد
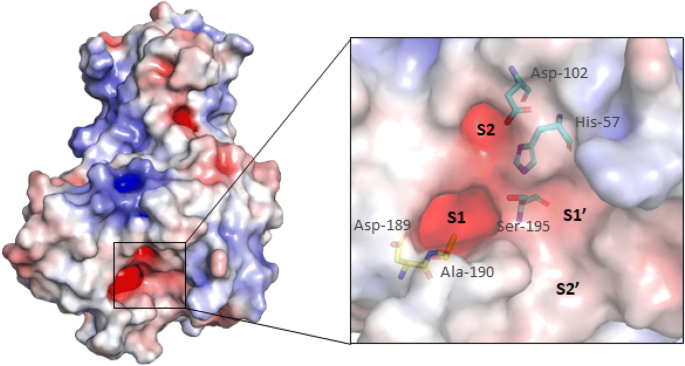
آب با دارا بودن ثابت دی الکتریک بالا ، قدرت پیوند یونی را کاهش می دهد. این مساله بدلیل اثر پوشانندگی مولکولهای دو قطبی آب و نزدیک شده آنها به ذرات باردار است. بیشتر میانکنشها الکترواستاتیک بین اسیدهای آمینه باردار یعنی اسید آسپارتیک، اسید گلوتامیک ( با بار منفی) و لیزین، آرژنین و هیستیدین ( با بار مثبت) در pH فیزیولوژیک و معمولا در نواحی سطحی پروتئین و در تماس با آب رخ می دهد و بنابراین ضعیف اند. مگر آنکه این اسیدهای آمینه در جایگاه فعال قرار گرفته باشند مانند توالی سه تایی[1] Asp-His-Ser که در جایگاه فعال سرین پروتئازها دیده می شود.
2-2 پیوند واندروالسی
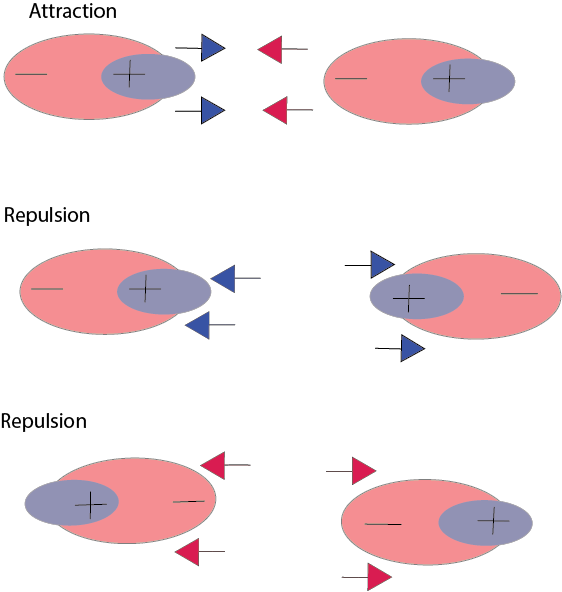
نیروهای واندروالسی به دسته ای میانکنشهای ناشی از القاء الکتریکی در مولکولها و یا اتمهای نزدیک به هم گفته می شود. بر اساس فیزیک کوانتوم و اصل عدم قطعیت هایزنبرگ، الکترونها مرتبا در اطراف هسته در گردش بوده و هرگز انرژی آنها به صفر نمی رسد. از این رو همواره این امکان وجود دارد که با گردش مداوم الکترون و یا ابر الکترونی، یک مولکول یا اتم دوقطبی ساخته شود. دو اتم با بار مثبت و منفی به خوبی همدیگر را جذب کرده و به هم متصل می شوند اما بسیاری از اتمها یا مولکولها به صورت دائم باردار نبوده و در نتیجه گردش ابر الکترونی اطراف آنها به صورت لحظه ای و یا القایی در یک سمت دارای بار مثبت ( فقدان ابر الکترونی) و در سمت دیگر بار منفی ( وجود ابر الکترونی) می شوند. این مولکولها و یا اتمها را دو قطبیهای لحظه ای یا موقتی می نامند.
این نیرو به صورت دائمی بین دو حالت جاذبه و دافعه در حال تغییر بوده و از این جهت مولکول ها را مرتبا به هم نزدیک و از هم دور می کند. از این جهت قدرت پیوند به فاصله بین دو مولکول بستگی دارد.
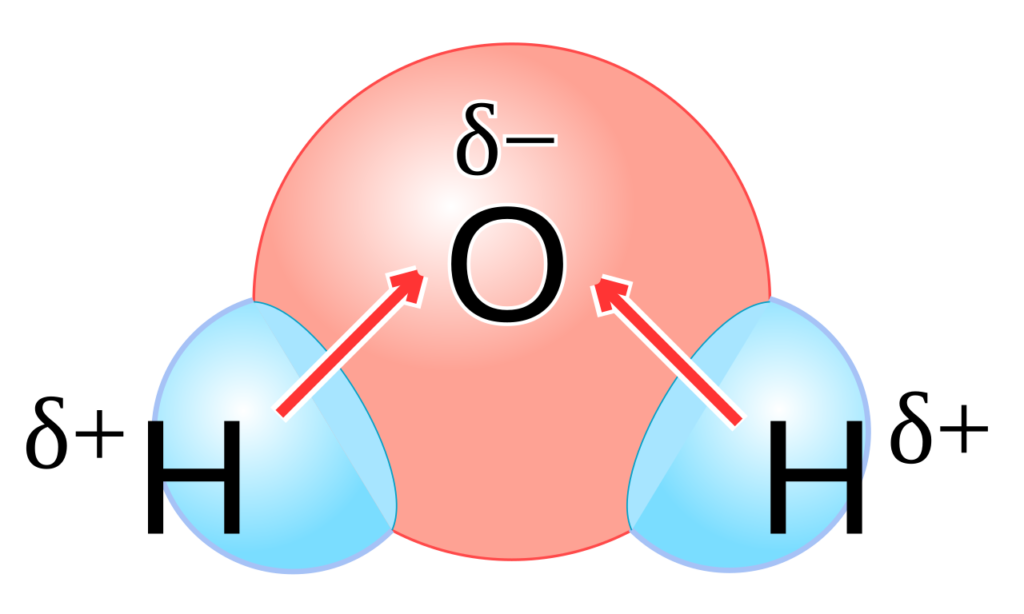
نیروهایی که تاکنون مورد بررسی قرار گرفته است مربوط به خود پروتئین و یا ماکرومولکول بوده و ارتباطی با محیط آبی اطراف آن ندارد. آب از حلالهای بسیار مهم است چراکه دمای ذوب و جوش بسیار بالایی دارد و به همین دلیل آب و یخ به عنوان عایق حرارتی در نظر گرفته می شوند. بعلاوه این حلال دارای ثابت دی الکتریک بالا و کشش سطحی قابل توجه نیز هست. پیوندی که چنین خواصی را به آب می بخشد پیوند هیدروژنی نام دارد. این پیوند بین یک اتم هیدروژن و یک اتم الکترونگاتیو مانند اکسیژن، فلوئور و نیتروژن تشکیل می شود. در این پیوند اتم هیدروژن دهنده و اتم الکترونگاتیو گیرنده الکترون است.
آب مولکولی قطبی است به این معنی که توزیع ابر الکترونی روی این مولکول به صورت یکنواخت نبوده و سر اکسیژن ابر الکترونی بیشتر (بار جرئی منفی) و سر هیدروژن ابر الکترونی کمتر ( بار جزئی مثبت) دارد.
در پیوند هیدروژنی، اتم هیدروژن دهنده و اتم اکسیژن گیرنده ابر الکترونی است. این پیوند جزء ضعیفترین پیوندهای غیرکووالان بوده و انرژی آن در حدود 5 کیلوکالری بر مول است ( بنابراین دمای محیط به راحتی آن را می شکند). به همین دلیل این پیوندها در حلال مرتبا در حال شکسته و تشکیل شدن هستند. با اینحال پیوند هیدروژنی یکی از پایدار کننده ترین پیوندها در ساختار ماکرومولکولهای زیستی است. بطوریکه ساختمان دوم پروتئینها عمدتا بوسیله پیوندهای هیدروژنی پایدار می شود. دلیل این امر وجود خاصیت تعاونی است که در این پیوند دیده می شود. به این معنی که پیوندهای هیدروژنی به صورت گروهی شکسته و تشکیل می شوند و بنابراین برای شکستن پیوند هیدروژنی باید تعداد زیادی از آنها را شکست. اما این خاصیت تمرکز ابر الکترونی روی اتمهای درگیر در پیوند هیدروژنی را کم کرده و فاصله بین آنها را نیز کاهش می دهد به همین دلیل انرژی دو پیوند هیدروژنی موجود در مولکولی مانند آب اندکی کمتر از دو پیوند است.
2-4 میانکنشهای هیدروفوب
بر اساس قانون دوم ترمودینامیک هر سیستمی تمایل دارد تا به صورت خودبخودی بی نظمی یا آنتروپی ( حرکت آزادانه) خود را افزایش دهد. این قانون مبنای یکی از مهمترین میانکنشهای موجود در ماکرومولکولهای زیستی یعنی میانکنشهای هیدروفوب است. در محیط آبی، گروههای غیر قطبی تمایل دارند تا با کنار هم قرار گرفتن، سطح دسترسی خود به آب را کاهش دهند. این فرایند با افزایش بی نظمی در آب نیز همراه است. در حقیقت دو جریان در شرایط قرار گیری مولکولهای هیدروفوب در آب وجود دارد. جریان اول مربوط به مولکولهای هیدروفوب و دیگری به مولکولهای آب مربوط است. مولکولهای هیدروفوب تمایلی ندارند تا با آب واکنش دهند اما از طرفی با توجه به اینکه نمی توانند با یکدیگر پیوندی تشکیل دهند، کنار هم قرار گرفتن آنها نیز مستلزم مصرف انرژی است. از طرف دیگر مولکولهای آب هم تمایلی به واکنش با مولکول هیدروفوب به قیمت کاهش آزادی حرکت را ندارند . در دمای 25 درجه سانتیگراد هر مولکول آب می تواند 3 تا 4 پیوند هیدروژنی با مولکولهای آب مجاور خود تشکیل دهد با ورود مولکول هیدروفوب، تعداد این پیوندها به شدت کاهش پیدا کرده و در نتیجه پایداری آن کم می شود. پس آب انرژی لازم برای کنار هم قرار گرفتن مولکولهای هیدروفوب را تامین می کنند و در حقیقت برای افزایش بی نظمی خود، نظم مولکولهای هیدروفوب را افزایش می دهند. به این ترتیب هم خود و هم مولکولهای هیدروفوب به حالت مطلوب خود می رسند. در این شرایط بی نظمی کل سیستم نسبت به حالت قبل بیشتر بوده و در نتیجه سیستم آب-چربی پایدار می شود. لازم به ذکر است که میانکنشهای هیدروفوب نقش اصلی را در تشکیل ساختار سوم پروتئینها دارند.
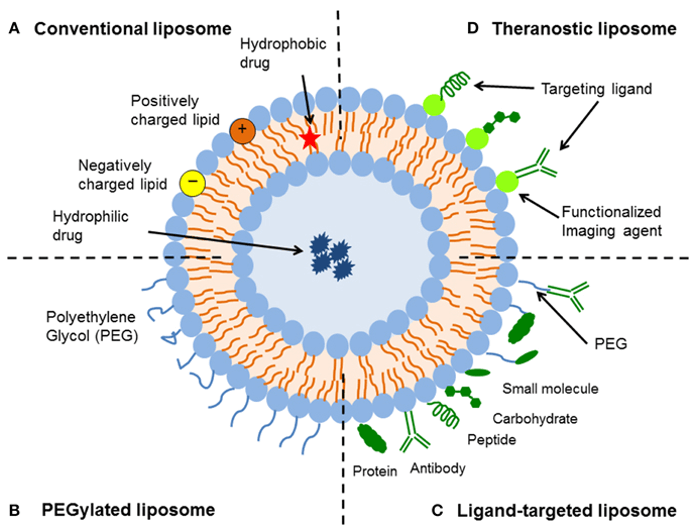
پیوندها یا میانکنشهای هیدروفوب یکی از میانکنشهایی هستند که نه تنها در تشکیل ساختار ماکرومولکولهایی مانند پروتئینها دخالت دارد که در شکل گیری غشاء سلولی نیز نقش اساسی را ایفا می کند. در نتیجه حضور مولکولهای دوگانه دوستی مانند فسفولیپیدها، مولکولهای آب برای کاهش سطح نظم خود ( افزایش بی نظمی)، مولکولهای فسفولیپیدی را در کنار یکدیگر جمع می کنند و در حدفاصل آب و هوا آنها را متمرکز می کنند که یک لایه لیپیدی روی سطح آب تشکیل می شود. در این حالت سرهای قطبی در تماس با آب و سرهای غیر قطبی در تماس با هوا قرار می گیرند. با افزایش غلظت فسفولیپید، مولکولهای آب شکل دیگری به فسفولیپیدها داده و آنها را به صورت توپهای توپری به نام میسل در می آورند. در این حالت دم های هیدروکربنی درون توپ و سرهای قطبی در سطح توپ و در تماس با آب قرار می گیرد. برای تشکیل میسل، غلظت فسفولیپیدها باید بیشتر از غلظت بحرانی میسلی شدن باشد. با افزایش غلظت فسفولیپید و به هم زدن مخلوط، اگر در محیط نمک وجود داشته باشد، ساختارهای فسفولیپیدی دولایه ای به نام لیپوزوم تشکیل شده که از نظر ساختاری شباهت فراوانی با غشاء سلولی دارد . معمولا ساختارهای لیپوزومی و میسلی را به عنوان ساختارهای کلوئیدی پایدار در سیستمهای آبی در نظر می گیرند.
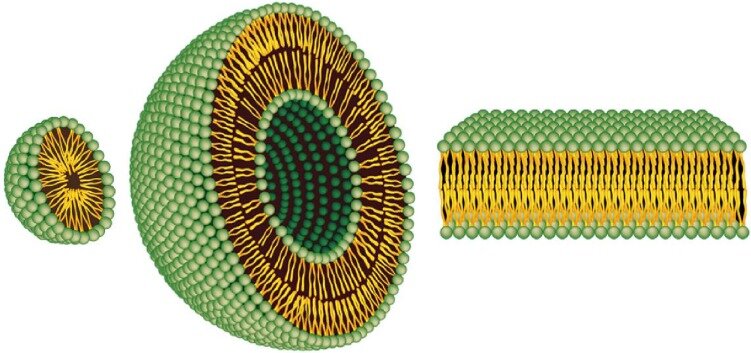
یکی از مهمترین کاربردهای ساختارهای لیپوزومی در دارورسانی هدفمند است. امروزه پیشرفت های قابل توجه ای در زمینه درمان انواع بیماریها با بهره گیری ازتکنیکهای نوین در سیستم های انتقال دارو صورت گرفته است. دارورسانی هدفمند به بافتهای بیمار یکی ازمهمترین وجوه این تکنیکها بشمار میروند. برای بسیاری از داروها لازم است که دارو در غلظت مناسب و در محل مناسب آزاد گردد تا بهترین تأثیر را داشته باشد. در این راستا، بوسیله سیستم های نوین انتقال دارو، داروها به محل مورد نظر منتقل و کمترین اثر جانبی را خواهند داشت. در ضمن می توان غلظت دارو را در حد مؤثر خود کنترل کرد. از سوی دیگر ویژگیهای آناتومی بدن مانند سدخونی مغزي، گذرگاه های پرشاخه سیستم تنفسی و اتصالات محکم سلول های پوستی، دارورسانی هدفمند بدون بکارگیری سیستم های نوین را غیرممکن می سازند. سیستم های دارو رسانی از جهت بکارگیری مواد و فرآیند تولید، محدودیت زیادی دارند. مواد این سیستم ها باید سازگاری زیستی با بدن داشته باشند و به آسانی به دارو متصل شوند و از بدن قابل حذف باشند و فرآیند تولید نیز به دقت کنترل گردد تا محصول حاوی دارو، فعالیت بیولوژیکی دارو را کاهش ندهد و از لحاظ قیمت نیز مناسب باشند. در بین حامل های مختلف، به تازگی نانوساختارها توانایی خود را جهت انتقال دارو بصورت هدفمند اثبات کردند. به همین علت، تحقیقات وسیعی در این زمینه در اکثر مراکز تحقیقاتی دنیا در حال انجام است که از مهمترین حوزه های این تحقیقات می توان به افزایش کارایی انتقال دارو، کنترل پروفایل رهایش، دارو و هدفمندسازی دارورسانی اشاره کرد.